Загрузка... 21 view(s)
1. Отдел биогеронтологии, Санкт-Петербургский институт биорегуляции и геронтологии, 197110 Санкт-Петербург, Россия
2. Группа пептидной регуляции старения, Институт физиологии им. Павлова Российской академии наук, Санкт-Петербург, 199004, Россия
*
Автор, которому следует направлять корреспонденцию.
Получено: 20 октября 2021 г./Пересмотрено: 16 ноября 2021 г./Принято к публикации: 18 ноября 2021 г./Опубликовано: 22 ноября 2021 г.
Абстрактный
Пептиды характеризуются широким спектром биологической активности: они регулируют функции эндокринной, нервной и иммунной систем. Механизм такого действия пептидов включает их способность регулировать экспрессию генов и синтез белков у растений, микроорганизмов, насекомых, птиц, грызунов, приматов и человека. Короткие пептиды, состоящие из 2–7 аминокислотных остатков, могут проникать в ядра и ядрышки клеток и взаимодействовать с нуклеосомами, гистоновыми белками, а также с одноцепочечной и двухцепочечной ДНК. Взаимодействия ДНК-пептид, включая распознавание последовательностей в промоторах генов, важны для реакций синтеза, направляемых матрицей, репликации, транскрипции и репарации. Пептиды могут регулировать состояние метилирования ДНК, которое является эпигенетическим механизмом активации или подавления генов как в нормальных условиях, так и в случаях патологии и старения. В этом контексте можно предположить, что короткие пептиды эволюционно были одними из первых сигнальных молекул, регулирующих реакции синтеза, направляемого матрицей. Эта ситуация повышает перспективы разработки эффективных и безопасных иммунорегуляторных, нейропротекторных, противомикробных, противовирусных и других лекарственных препаратов на основе коротких пептидов.
Ключевые слова:
короткие пептиды; взаимодействия ДНК-пептид; гистоны; эпигенетика; пептидные препараты1. Введение
Пептиды — это молекулы, содержащие от 2 до 100 аминокислотных остатков, связанных амидными (пептидными) связями. Пептиды можно рассматривать как полипептиды или олигопептиды в зависимости от количества присутствующих аминокислотных остатков. При этом полипептиды, как предполагается, содержат до 100 аминокислотных остатков на молекулу, тогда как олигопептиды (короткие пептиды) содержат только до 10. Макромолекулы, содержащие более 100 аминокислотных остатков, называются белками. Следует отметить, однако, что согласно классификации Международного союза чистой и прикладной химии (IUPAC), «короткие» пептиды состоят из 10–20 аминокислотных остатков, тогда как «полипептиды» включают 20 и более аминокислотных остатков [1,2]. Между тем, другая классификация рассматривает «короткие» пептиды как соединения, содержащие до 40 аминокислотных остатков [3]. Кроме того, существует группа ультракоротких пептидов, которые, согласно некоторым литературным источникам, состоят всего из 2–4 аминокислотных остатков [4], а согласно другим – из 3–7 аминокислот [5].
В целом, независимо от количества аминокислотных остатков в их составе, пептиды поддерживают многие ключевые процессы в организме благодаря своим антиоксидантным, противомикробным, антибактериальным, противовоспалительным, противораковым, противоопухолевым и иммунорегуляторным свойствам [6,7,8].
Пептиды выполняют различные биологические функции: они регулируют функции эндокринной, нервной и иммунной систем. Активность пептидов характеризуется широким спектром их биологических свойств, включая регуляцию клеточной дифференцировки, апоптоза и пролиферации. Таким образом, изучение механизмов физиологической активности пептидов представляет большой интерес для исследователей, работающих в сфере молекулярной биологии, фармакологии и медицины [9].
Важным этапом в изучении биологической активности пептидов стало выделение полипептидных экстрактов из различных органов животных, а также дальнейшее конструирование и синтез коротких пептидов длиной 2–4 аминокислотных остатка [8,10]. Авторы выявили так называемые цитомедины (от греческого слова «κύτος» — «клетка» и латинского слова «посредник» — «посредник»), активность которых характеризуется широким спектром биологических свойств, в том числе и в межклеточной сигнализации [11,12]. Была предложена схема, согласно которой информация, поступающая в организм, а также ответный сигнал контролируются системой биологической регуляции (рис. 1). Главная задача этой системы биологической регуляции — регулирование генома и обеспечение функционирования защитных функций (иммунных, репаративных и адаптивных процессов), которые имеют общие регуляторные механизмы. Предполагалось, что, проникая в клетку, регуляторные пептиды взаимодействуют с геномом и, таким образом, контролируют его функциональную активность.
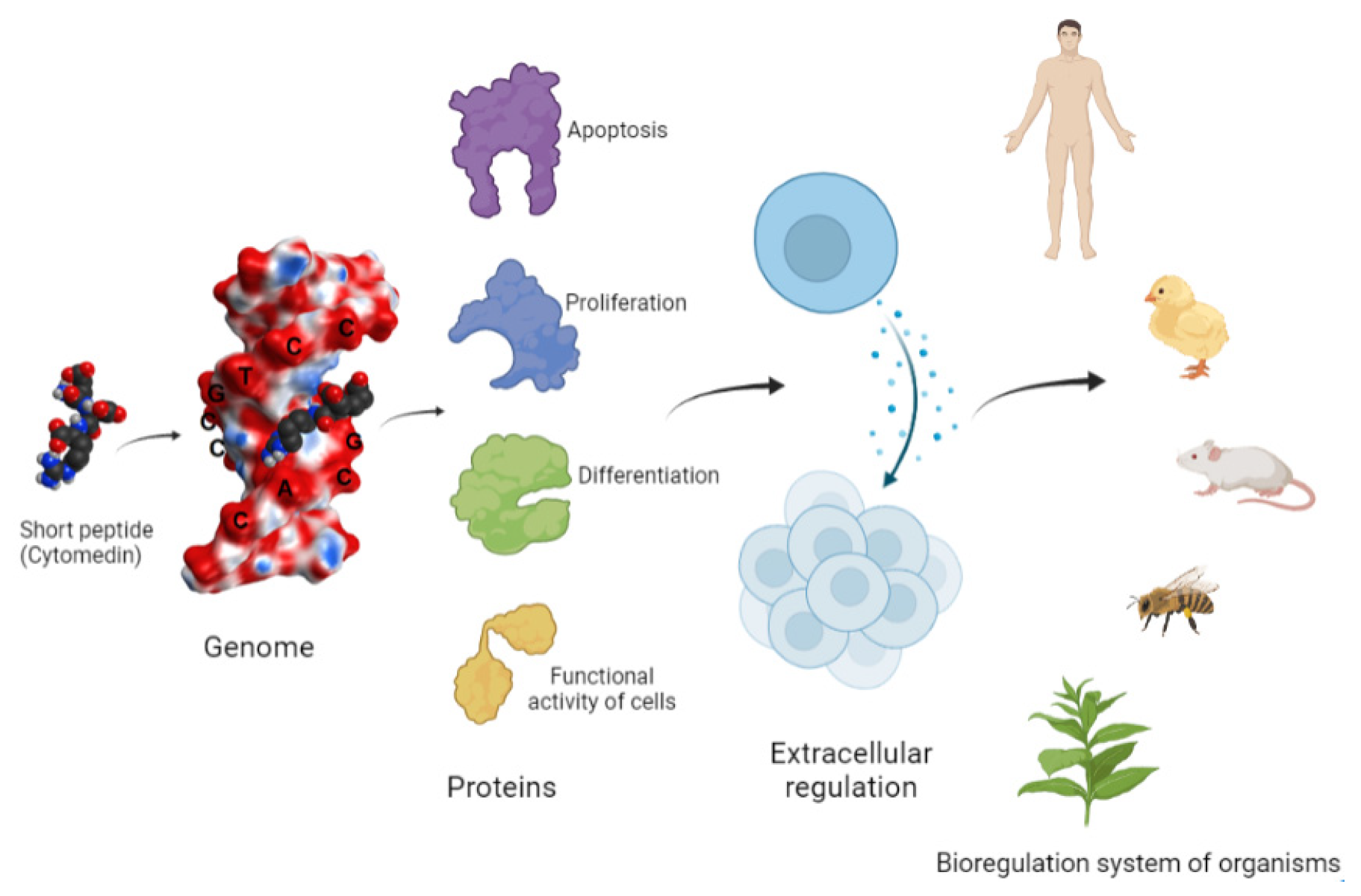
Рисунок 1. Система биорегуляции многоклеточного организма (по Морозову и Хавинсону, 1983 г., с модификациями).
Исследования биологической активности цитомединов, полученных из тканей различных органов, продемонстрировали специфичность их действия в отношении клеточных популяций, являющихся их источником. Результаты показали участие цитомединов в регуляции клеточной дифференциации и пролиферации, а также их способность изменять функциональную активность генома на разных фазах клеточного цикла [ 11 , 12 , 13 ].
Дальнейшие экспериментальные исследования in vitro и in vivo установили обширную биологическую активность полипептидов и коротких пептидов, проявляющуюся в иммуномодулирующей, противораковой и геронтопротекторной активности [ 8 , 14 ]. Выявленные биологические эффекты цитомединов породили множество исследований механизмов их действия. Многочисленные исследования продемонстрировали специфическое взаимодействие ДНК-пептид [ 15 , 16 , 17 , 18 , 19 , 20 , 21 , 22 ]. Пептиды EDR, AEDG, AEDL, KEDW, AEDR и KEDG могут связываться с гистоновыми белками H1, H2b, H3 и H4, увеличивая доступность транскрипции в зонах промоторов генов [ 15 ]. Пептиды KE, AEDG и AEDL стимулируют экспрессию семейств генов CLE, KNOX1 и GFR, участвующих в дифференцировке клеток растения Nicotiana tabacum [ 16 ]. Пептиды KE, AED, KED и AEDG регулируют экспрессию генов нейрогенеза (нестин, β-тубулин III, даблкортин, GAP43, SUMO), старения (p16, p21), функциональной активности (IFG-1, FOXO1, TERT, TNKS2, NFkB) и циркадных ритмов (Clock, Csnke1, Cry2) в стволовых клетках и лимфоцитах крови человека посредством специфических взаимодействий ДНК-пептид и/или связывания с гистонами H1/3 и H1/6 [ 17 , 18 , 19 , 20 , 21 , 22 ].
Данное исследование привело к выводу, что биологические эффекты пептидов основаны на их способности регулировать экспрессию генов и синтез белка посредством таких взаимодействий ДНК-пептид [ 23 , 24 ].
Следует отметить, что первые работы по возможному взаимодействию ДНК-пептид, проведенные в период с 1975 по 1979 год, касались в основном только специфики действия низкомолекулярных пептидов, полученных из тимуса [ 25 , 26 ].
Однако авторы не связали физические и химические свойства пептидов с их потенциальной биологической функцией.
Данный обзор посвящен изучению взаимосвязи биологической функции пептидов и их способности регулировать экспрессию генов посредством связывания с ДНК. Исследований в этой области очень мало по сравнению, например, со значительным объемом данных, доступных по метилированию ДНК и/или ацетилированию гистонов, связыванию пептидов с факторами транскрипции и т. д. [ 27 ]. Однако исследования паттернов взаимодействия ДНК-пептид, выявленных in vitro, помогают охарактеризовать специфичность действия коротких пептидов. Кроме того, исследование такого механизма действия пептидов может стать основой для разработки лекарств для лечения различных заболеваний. Следовательно, цель данного обзора — представить обзор имеющейся информации о роли взаимодействия ДНК-пептид в регуляции экспрессии генов, синтеза белка и физиологических функций.
2. Биологические эффекты пептидов
Современные представления о пептидных соединениях указывают на то, что пептиды, полученные различными способами (гидролиз, экстракция и/или синтез), обладают широким спектром биологических эффектов: иммуномодулирующими, нейропротекторными, противомикробными, противовирусными, противораковыми и т. д.
Существует несколько всеобъемлющих обзоров пептидов морского происхождения. Их авторы подробно описывают антигипертензивные, антиоксидантные, антимикробные, нейропротекторные и геронтопротекторные свойства этих пептидов, но также подчеркивают трудности, с которыми они столкнулись при экстракции и очистке пептидов морского происхождения, что, следовательно, может служить препятствием для разработки лекарственных препаратов [ 6 , 7 , 28 , 29 ].
Маэстри и др. в своем метаанализе представили обширный обзор вклада 807 биологически активных пептидов из пищевых продуктов животного происхождения (молоко, мясо, яйца и морепродукты). Важно отметить, что авторам удалось установить корреляцию между структурой пептида и его активностью (антигипертензивной, антиоксидантной, иммуномодулирующей, противомикробной, гиполипидемической, антитромботической и опиоидной) и стабильностью in vivo [ 30 ]. Следует, однако, подчеркнуть, что современные представления о биологической активности пептидов также включают нейропротекторные и другие эффекты, которые в данном исследовании не были описаны.
Изучено множество биологических свойств экстрактов, полученных из органов крупного рогатого скота, а также некоторых синтетических пептидов [ 8 ]. Было показано, что пептидные экстракты, выделенные из тканей различных органов, обладают выраженными геронтопротекторными, противораковыми, иммуномодулирующими и нейропротекторными свойствами, включая способность регулировать функции эндокринной системы [ 14 , 31 ]. При изучении их состава основными компонентами экстрактов были идентифицированы ди- и тетрапептиды, оба обладающие сходными биологическими эффектами [ 8 ].
Таким образом, многолетнее изучение биологических характеристик пептидов позволило сделать выводы о способности таких соединений регулировать физиологические процессы как в нормальных, так и в патологических условиях.
3. Регуляция экспрессии генов и синтеза белка пептидами
Экспрессия генов опосредует клеточные процессы от дифференцировки, функциональной активности и апоптоза [ 32 ]. Понимание механизмов регуляции экспрессии генов позволяет определить, как корректировать жизненную активность клеток, пораженных различными патологиями. Короткие пептиды с молекулярной массой до 3 кДа считаются особенно активными в регуляции экспрессии генов, обладая способностью проникать через цитоплазматическую и ядерную мембраны клеток [ 33 ] и влиять на экспрессию специфических генов [ 23 , 34 , 35 ]. Было обнаружено, что пептиды AEDG и KE регулируют экспрессию 98 и 36 генов соответственно [ 23 , 34 ]. Было выявлено, что тетрапептиды AEDG и AEDP активируют дифференцировку плюрипотентных клеток в направлении эпидермиса, мезенхимы и нервной ткани. Пептиды KE, AED, KED, AEDG и AAAAEKAAAAEKAAAAEK являются активаторами нейрональной дифференцировки. Пептид AEDL стимулирует дифференцировку клеток легких, а пептид KEDW стимулирует созревание различных типов клеток поджелудочной железы человека. К пептидам, активирующим иммуногенную дифференцировку, относятся KE, DS, (Nα- (γ-E) -E), K (HE-OH) -OH, AED, KED, EDA и KEDG. К регуляторам остеогенной дифференцировки относятся пептиды IRW, GRGDS и YCWSQYLCY. В каждом случае пептид активирует экспрессию генов, кодирующих белки, характерные для фенотипа соответствующей субпопуляции клеток данной ткани [ 35 ]. Это свойство пептидов имеет первостепенное значение, поскольку указывает на значительную роль пептидной регуляции экспрессии генов в таких биологически важных процессах, как клеточная дифференциация, функциональная активность, старение, апоптоз, иммуногенез и нейрогенез.
3.1. Пептидная регуляция клеточной дифференцировки
Дифференцировка клеток — один из основных физиологических механизмов, поддерживающих функциональную активность и гомеостаз органов и тканей. В случае старения и при различных патологиях часто наблюдается нарушение дифференцировки клеток. Таким образом, идентификация веществ, индуцирующих дифференцировку, является актуальной темой в биогеронтологии и регенеративной медицине. Короткие пептиды рассматриваются как одна из таких групп биологически активных молекул.
Самособирающиеся пептиды (САП), называемые модифицированными пептидами, играют важную роль в регуляции дифференцировки. Эти короткие пептиды содержат аминокислотные остатки, модифицированные ковалентными связями, в результате чего они организуются в нановолоконные структуры. Пептид IKVAV является членом группы САП и, как было показано, активирует нейрогенную дифференцировку стволовых клеток [ 36 ]. Пептиды KLDL и RADA являются стимуляторами остеогенной и хондрогенной дифференцировки. RADA в сочетании с лигандом фактора Notch-1 (Jagged1) активирует дифференцировку предшественников клеток сердца. Это наблюдается в стимуляции экспрессии генов следующих транскрипционных факторов: Nkx2.5, Hey1, MEF2C и GATA4 [ 37 ]. Было высказано предположение, что способность SAP индуцировать направленную дифференциацию стволовых клеток открывает их потенциал для рассмотрения в разработке лекарств, которые могли бы быть эффективны при сердечно-сосудистых патологиях и нейродегенеративных заболеваниях (болезнь Альцгеймера и болезнь Паркинсона) [ 36 ]. Было показано, что трипептид RGD стимулирует остеогенную дифференциацию мезенхимальных стволовых клеток [ 38 ]. В отличие от этого, короткие циклические пептиды A–IF и HI ингибируют способность остеокластов к дифференциации [ 39 ].
Направление индукции клеточной дифференцировки зависит от структуры и концентрации контролирующего ее пептида (пептидов). Диапазон эффективных концентраций коротких пептидов, регулирующих клеточную дифференцировку, обычно составляет от 2 до 200 нг/мл, но зависит от структуры пептида, характеристик изучаемой клеточной культуры и других аспектов экспериментального дизайна [ 34 ].
Пептиды AEDG и AEDP вызывают дифференцировку плюрипотентных клеток эпидермиса, мезенхимы и нервной ткани [ 17 , 20 , 34 ]. Пептиды KE, AED, KED, AEDG [ 34 ] и AAAAEKAAAAEKAAAAEK [ 40 ] активируют нейрональную дифференцировку. Было показано, что пептид AEDL индуцирует дифференцировку клеток легких путем регуляции экспрессии генов NKX2-1 , SCGB1A1 , SCGB3A2 , FOXA1 и FOXA2 [ 41 ]. Другое исследование показало, что пептид KEDW увеличивает экспрессию генов PDX1 , NGN3 , MNX1 , PAX6 , FOXA2 , NKX2-2 , NKX6.1 , HOXA3 и PAX4 , которые важны для поддержания функциональной активности эндокринных клеток поджелудочной железы [ 42 ]. Установлено, что направленная дифференцировка иммунных клеток стимулируется пептидами KE, DS, (Nα-(γ-E)-E), K(HE-OH)-OH, AED, KED, EDA и KEDG [ 34 ]. Между тем, IRW [ 43 ], GRGDS [ 44 , 45 ] и YCWSQYLCY [ 46 ] активируют остеогенную дифференцировку стволовых клеток.
Кроме того, пептиды KE, AEDL и AEDG также могут индуцировать дифференциацию растительных клеток. В частности, AEDG и AEDL усиливают рост культуры и могут стимулировать образование и рост листьев у регенерированных растений каллусных культур табака ( Nicotiana tabacum ). Поскольку регуляторная активность коротких пептидов проявляется при низких концентрациях, их действие в некоторой степени аналогично действию фитогормонов, носит сигнальный характер и имеет эпигенетическую природу. Изученные к настоящему времени пептиды модулируют экспрессию генов в клетках табака, включая гены, ответственные за развитие тканей и дифференциацию клеток. Эти пептиды модулируют экспрессию семейства генов CLE, кодирующих известные эндогенные регуляторные пептиды, генов KNOX1 (гены транскрипционных факторов) и семейства генов GRF (факторы регуляции роста), кодирующих соответствующие ДНК-связывающие белки, такие как топоизомеразы, нуклеазы и т. д. [ 16 , 24 ].
Исследования в области направленной на стволовые клетки дифференцировки посредством пептидной регуляции имеют особое значение для разработки инновационных подходов в молекулярной медицине и клеточной терапии. Такие пептиды могут стать полезными дополнительными инструментами для стимуляции клеточной дифференцировки, регенерации тканей и цитопротекции при лечении различных заболеваний человека, а другие области применения пептидов, вероятно, найдут применение в экспериментальной ботанике, молекулярной биологии растений, биотехнологии и практической агрономии.
3.2. Пептидная регуляция функциональной активности клеток
Функциональная активность клеток лежит в основе поддержания гомеостаза организма, но нарушается при заболеваниях и старении. Основные функции эукариотических клеток включают поддержание постоянного внутриклеточного электролитного состава и концентрации питательных веществ, включая глюкозу, структурирование цитоскелета, эндо- и экзоцитоз, реакцию на внеклеточные сигналы, определяющие жизнеспособность, миграцию, пролиферацию, дифференцировку и биоэлектрогенез [ 47 ]. Короткие пептиды являются сигнальными мессенджерами, регулирующими такие основные клеточные функции [ 48 ].
Было показано, что в случае метаболического стресса (недостатка глюкозы) пептид MOTS-c, кодируемый митохондриальным геномом, проникает в ядро клетки и активирует экспрессию генов ядерного антиоксидантного ответа. Таким образом, пептид MOTS-c регулирует клеточный гомеостаз, связывая митохондриальный геном с ядром [ 49 ]. Другой пептид, регулирующий метаболизм, — это гастрин-высвобождающий пептид. Этот пептид активирует экспрессию гена проглюкагона в энтероэндокринных клетках линии STC-1 [ 50 ].
Пептид AEDG регулирует экспрессию генов циркадного ритма Clock , Csnk1e и Cry2 в лейкоцитах и лимфоцитах крови людей с подавленной функцией шишковидной железы, вырабатывающей мелатонин [ 19 ]. Ранее также было установлено, что AEDG восстанавливает мелатонин-образующую функцию шишковидной железы, которая обычно снижается в процессе старения, и что он как увеличивает продолжительность жизни, так и ингибирует старение репродуктивных функций у экспериментальных животных [ 51 ]. Возможно, что AEDG регулирует экспрессию генов циркадного ритма не только в клетках крови, но и в других органах и тканях, что объясняет его геронтопротекторный эффект и влияние на функции органов нейроиммуноэндокринной системы.
Гексапептид HAV (Ac-SHAVSS-NH2) регулирует экспрессию генов, продукты которых участвуют в синтезе Е-кадгерина и обеспечивают адгезию клеток слизистой оболочки кишечника (линия Caco-2). Изменение экспрессии этих генов под воздействием HAV сопровождается снижением синтеза Е-кадгерина на 20% [ 52 ].
Было установлено, что AEDL участвует в регуляции функциональной активности бронхиального эпителия. Этот тетрапептид активирует экспрессию генов MUC4 , MUC5AC и SFTPA1 , снижение экспрессии которых коррелирует с развитием бронхолегочной патологии [ 41 ].
Была также выявлена способность коротких пептидов регулировать функциональную активность клеток головного мозга. В случае церебральной ишемии у крыс пептиды MEHFPGP (аналог N-концевого фрагмента адренокортикотропного гормона) и PGP продемонстрировали нейропротекторные свойства, регулируя экспрессию мРНК генов фактора роста сосудистого эндотелия Vegf-a , Vegf-b , Vegf-c , Vegf-d и Plgf , которые способствуют регенерации сосудистого органа [ 53 , 54 ]. В ходе ПЦР в реальном времени было показано, что MEHFPGP, а также пептидный препарат Семакс (этиловый эфир N-фенилацетил-L-пролилглицина) увеличивают экспрессию мРНК генов нейротрофинов: фактора роста нервов (NGF) и нейротрофического фактора головного мозга (BDNF) в различных областях мозга крысы [ 55 ]. Кроме того, Семакс также регулировал экспрессию генов и синтез стресс-индуцированных киназ SAPK/JNK46/54 и pERK1/2, активация которых связана с развитием нейродегенеративных заболеваний [ 56 ]. Трипептид PGP увеличивал экспрессию мРНК генов, кодирующих нейтрофины и их рецепторы TrkA , TrkB , TrkC и p75 в лобных долях головного мозга, гиппокампе и мозжечке крыс в условиях церебральной ишемии [ 53 ]. Более того, MEHFPGP нормализовал экспрессию гена c-Fos и синтез белка, кодируемого этим геном, в паравентрикулярном гипоталамусе и медиальной перегородке головного мозга крыс, предрасположенных к эмоциональному стрессу [ 57 ]. Гептапептид TKPRPGP регулировал экспрессию мРНК 45 генов, участвующих в процессах нейротрансмиссии (основная субъединица рецептора ГАМК, белки ионных каналов, рецепторы дофамина и серотонина и др.) в лобной коре головного мозга крысы [ 58 , 59 ].
Важно отметить, что вазопротекторный пептид KED [ 60 ], обладающий нейропротекторным эффектом в моделях болезни Альцгеймера у мышей in vitro и in vivo [ 61 , 62 ], регулировал мРНК, участвующую в экспрессии генов клеточного старения и апоптоза ( p16 , p21 ), нейрогенеза ( NES , GAP43 ) и других генов, участвующих в патогенезе болезни Альцгеймера ( SUMO1 , APOE , IGF1 ) [ 22 ]. Следует отметить, что поскольку такие короткие пептиды могут регулировать экспрессию генов, ответственных за функции клеточных популяций головного мозга, это указывает на многообещающие перспективы использования коротких пептидов для нейропротекции.
Еще одна область, связанная с пептидной регуляцией экспрессии генов, — это регуляция функциональной активности клеток иммунной системы. Было обнаружено, что иммуномодулирующий пептид TKPRPGP изменяет экспрессию мРНК 34 генов хемокинов, цитокинов и их рецепторов в селезенке мыши. В частности, наибольшие изменения под воздействием пептида наблюдались в экспрессии мРНК гена Bcl6 , который имеет первостепенное значение в формировании и развитии иммунной системы [ 63 , 64 ]. Для изучения изменений в экспрессии генов, вызванных MEHFPGP в тканях коры головного мозга крысы во время очаговой ишемии, использовался геномный экспрессионный чип RatRef-12 Expression BeadChip (Illumina, Сан-Диего, Калифорния, США). Было показано, что этот короткий пептид изменяет экспрессию мРНК для 96 генов, связанных с количеством и подвижностью иммунных клеток, функциональной активностью хемокинов и иммуноглобулинов, а также генов, участвующих в таких процессах, как развитие и миграция клеток эндотелиальной ткани, миграция гладкомышечных клеток, гемопоэз и васкулогенез [ 65 , 66 ]. Таким образом, пептидная регуляция функциональной активности клеток иммунной системы может стать основой иммунозащиты с помощью коротких пептидов. Анализ вышеупомянутых исследований показывает, что короткие пептиды обладают общими иммуно- и нейропротекторными свойствами. Это может послужить основой для комплексной терапии нейродегенеративных заболеваний.
В ранее упомянутом исследовании с использованием технологии ДНК-микроматриц была установлена способность пептидов EW, KE и AEDG регулировать экспрессию широкого спектра генов [ 23 ]. На основе базы данных GeneCards была выявлена тенденция к исследованию способности пептидов регулировать такие биологические процессы, как энергетический гомеостаз, воспаление, апоптоз, клеточный стресс и т. д. Более того, были обнаружены связи перечисленных генов с развитием различных патологий, включая нейропатии, иммунодефициты и рак ( табл. 1 , табл. 2 и табл. 3 ).
Таблица 1. Гены и белки, участвующие в патогенезе различных заболеваний, экспрессия которых регулируется пептидом EW.
| Ген | Белок | Функция/Биологический процесс | Расстройства |
|---|---|---|---|
| MT-ATP6 (ATP6) | Субъединица А АТФ-синтазы | синтез АТФ, транспорт ионов водорода | Нейропатия, атаксия, пигментный ретинит, синдром Ли |
| МТ-НД1 | Основная субъединица 1 НАДН-убихинон-оксидоредуктазы | электронный транспорт | Наследственная атрофия зрительного нерва Лебера, дефицит митохондриального комплекса I, синдром MELAS, наследственная оптическая нейропатия Лебера, дистония |
| МТ-НД4 | Цепь 4 НАДН-убихинон-оксидоредуктазы | Наследственная оптическая нейропатия Лебера, модификатор митохондриальной миопатии, энцефалопатия, лактатный ацидоз, инсультоподобные эпизоды | |
| МТ-CO1 | субъединица 1 цитохром-с-оксидазы | Глухота, несиндромная сенсоневральная, митохондриальная и генетическая рецидивирующая миоглобинурия | |
| АК2 | аденилат киназа 2 | клеточный энергетический гомеостаз, метаболизм адениновых нуклеотидов | Ретикулярная дисгенезия, иммуноэритромиелоидная гипоплазия, атопический дерматит, тяжелый комбинированный иммунодефицит |
| HBA1,2 | Альфа-субъединица гемоглобина | транспорт кислорода | Эритроцитоз, семейный 7 и гемоглобиновая болезнь h, альфа-талассемия |
| COP1 | E3 убиквитин-протеинлигаза COP1 | убиквитинирование и протеасомная деградация целевых белков | аутизм |
| PDLIM5 (Enh2) | Белок 5 с PDZ- и LIM-доменами | Регуляция расширения кардиомиоцитов и развития сердца посредством связывания PKC с областью Z-диска. | Синдром ногтевой пателлы, биполярное расстройство |
| HSP90AB1 | семейство белков теплового шока 90 | сворачивание и деградация белков, апоптоз в желудке и воспаление | Рак гортани, энцефалит Повассана |
| HSPBAP1 (Pass1) | Белок 1, ассоциированный с белком теплового шока (27 кДа) | клеточная стрессовая реакция, рост и дифференциация клеток | Почечноклеточный рак, непапиллярный, эпителиальная рецидивирующая эрозионная дистрофия |
| гены HLA | антигены человеческих лейкоцитов | Активность рецепторов MHC класса II/адаптивный иммунитет, взаимодействие хозяина и вируса, врожденный иммунитет | Ревматоидный артрит, сахарный диабет 1 типа, саркоидоз сердца, корь, бериллиоз, гранулематоз с полиангиитом, галоневусы, полиартикулярный ювенильный идиопатический артрит, розовый лишай, фетальная и неонатальная аллоиммунная тромбоцитопения, синдром Грэма-Литтла-Пиккарди-Лассюра, аллергия на пенициллин, инфекция цитомегаловирусом человека, астма, тяжелая преэклампсия, целиакия 1 типа, миастения гравис с началом во взрослом возрасте, псориаз 1 типа, вирус иммунодефицита человека 1 типа, тяжелая кожная побочная реакция, хориоретинопатия типа «дробовая дробь», целиакия 1 типа, болезнь Крейцфельдта-Якоба, саркоидоз 1 типа, рассеянный склероз |
Таблица 2. Гены и белки, участвующие в патогенезе различных заболеваний, экспрессия которых регулируется пептидом KE.
| Ген | Белок | Функция/Биологический процесс | Расстройства |
|---|---|---|---|
| EPS15 | субстрат 15 пути рецептора эпидермального фактора роста | Эндоцитоз, опосредованный клатрином, и развитие сигнального пути HGF. | Вакциния, катаракта 8 множественных типов, болезнь Менкеса, аутосомно-рецессивная спастическая параплегия 20 типа |
| MCM10 | Мини-хромосома, фактор инициации репликации 10 | пролиферация клеток, клеточный ответ на повреждение ДНК, репликация ДНК | Иммунодефицит 80 с врожденной кардиомиопатией или без нее, синдром Баллера-Герольда, синдром Рападилино, синдром Ротмунда-Томсона 2 типа, анемия Фанкони |
| Кул 5 | куллин-5 (CUL-5, рецептор 1, мобилизующий кальций, активируемый вазопрессином, VACM-1) |
ключевой компонент множественных комплексов E3 убиквитин-протеинлигазы ECS (Elongin-Cullin 2/5-SOCS-box protein), подобных SCF, которые опосредуют убиквитинирование и последующую протеасомную деградацию целевых белков. | Контагиозный моллюск, синдром Кокейна, рак легких |
| APG5L | аутофагический белок 5 | образование аутофагических везикул, контроль качества митохондрий после окислительного повреждения, отрицательная регуляция врожденного противовирусного иммунного ответа, развитие и пролиферация лимфоцитов, презентация антигенов MHC II, дифференцировка адипоцитов, апоптоз | Спиноцеребеллярная атаксия 25, стоматит |
| ZNF01 | гомолог белка с цинковым пальцем 1 | связывание нуклеиновых кислот, активность транскрипционного фактора, связывающего ДНК. | Ретинобластома и нейропатия |
| FLJ12848 в (TNPO3) | транспорт-3 | активность рецептора сигнала ядерного импорта, связывание малой ГТФазы | Мышечная дистрофия, поясно-конечностная, аутосомно-доминантная 2 типа |
| ИТПК1 | инозитол-тетракисфосфат-1-киназа | Метаболизм инозитолфосфата, некроптотический процесс, развитие нервной трубки | Дефекты нервной трубки |
| SLC7A6 | Транспортер аминокислот Y + L 2 | Трансмембранный транспорт аминокислот, миграция лейкоцитов, транспорт орнитина | Непереносимость лизинурического белка, цистинурия при гепатоцеллюлярной карциноме, синдром персистирующего фетального кровообращения |
| KIAA0699 (BICD2) | белок бикаудальный D гомолог 2 | Ретроградный транспорт от Гольджи к ЭР | Спинальная мышечная атрофия, преимущественно поражающая нижние конечности, аутосомно-доминантное происхождение. |
| FLJ10914 (MRGBP) | Белок, связывающий MRG/MORF4L | ацетилирование нуклеосомных гистонов H4 и H2A | Рак толстой кишки, аденома толстой кишки |
| Гдап1 | Ганглиозид-индуцированный белок, ассоциированный с дифференцировкой 1 | метаболический процесс глутатиона, деление митохондрий, слияние митохондрий, импорт белков в мембрану пероксисомы, направленное перемещение белков в митохондрии | Болезнь Шарко-Мари-Тута |
| MSTP028 (KCTD10) | Адаптер, содержащий домен BTB/POZ, для белка 3, участвующего в деградации RhoA, опосредованной CUL3. | Синтез ДНК и пролиферация клеток | Метилмалоновая ацидурия типа CBlB, профессиональный дерматит |
Таблица 3. Гены и белки, участвующие в патогенезе различных заболеваний, экспрессия которых регулируется пептидом AEDG.
| Ген | Белок | Функция/Биологический процесс | Расстройства |
|---|---|---|---|
| RAD21 | Гомолог белка репарации двухцепочечных разрывов ДНК rad21 | апоптоз, клеточный цикл, деление клеток, разделение хромосом, повреждение ДНК, репарация ДНК, митоз, транскрипция, регуляция транскрипции | Синдром Корнелии де Ланге 4, синдром Мунгана |
| ТОП3Б | ДНК-топоизомераза III бета | Рекомбинация ДНК, клеточное старение и поддержание стабильности генома | Синдром дупликации хромосомы 22Q11.2 Прозопагнозия |
| АК2 | Аденилат киназа 2 | клеточный энергетический гомеостаз, метаболизм адениновых нуклеотидов | Ретикулярная дисгенезия, иммуноэритромиелоидная гипоплазия, атопический дерматит, тяжелый комбинированный иммунодефицит |
Таким образом, литературные источники демонстрируют результаты многочисленных исследований, доказывающих способность коротких пептидов регулировать экспрессию генов, связанных с различными типами клеточной функциональной активности и широким спектром биологических процессов. Связь генов, активность которых регулируется короткими пептидами, с развитием патологических процессов открывает перспективы использования коротких пептидов в качестве биологически активных соединений для регулирования физиологических процессов, а также в разработке лекарственных препаратов для лечения различных патологий.
3.3. Регуляция старения и апоптоза пептидами
Учитывая прогнозируемое увеличение продолжительности жизни, сейчас важно разработать стратегии для поддержания активного долголетия. Короткие пептиды представляют собой одну из перспективных групп геронтопротекторов, которые могли бы это обеспечить. Клеточное старение — это процесс, приводящий к необратимой остановке клеточного цикла. В случае старения клетки приобретают характерные метаболические и сигнальные особенности, которые в совокупности называются секреторным фенотипом, связанным со старением (SASP). Начало SASP типично для ряда возрастных патологий, включая различные злокачественные новообразования. Пептиды являются одним из потенциальных терапевтических средств для подавления SASP и предотвращения неблагоприятных последствий клеточного старения [ 67 ].
Например, митохондриальные пептиды (МДП) являются важными митохондриальными компонентами, которые активируют сигнальные пути и модулируют экспрессию ядерных генов. МДП хорошо представлены пептидами гуманином и MOTS-c. В случае старения синтез этих пептидов снижается, что приводит к потере физиологической функции. Снижение уровня МДП также связано с возрастными заболеваниями [ 68 ].
Известно, что транскрипционный фактор FOXO4 поддерживает жизнеспособность стареющих клеток, подавляя их реакцию на апоптоз. Вмешательство в сигнализацию FOXO4 может быть стратегией по устранению стареющих клеток и имеет потенциал в качестве лечения возрастных заболеваний. Исследования химической природы пептидов показали, что белковые домены, содержащие природные L-пептиды, иногда можно имитировать, используя D-аминокислоты в обратном порядке [ 69 ]. Модификация пептидов с помощью этой D-ретро-инверсной (DRI) изоформы может придавать пептидам новые химические свойства, что, в свою очередь, может повысить их эффективность in vitro и in vivo [ 70 ]. В клинических испытаниях несколько DRI-модифицированных пептидов оказались хорошо переносимыми и терапевтически эффективными. Например, двойное слепое рандомизированное плацебо-контролируемое исследование фазы IIb [ 71 ] и исследование фазы I системного лечения солидных опухолей [ 72 ] продемонстрировали преимущество DRI-пептидов в клинической терапии. Было обнаружено, что синтезированный пептид в DRI-конформации, называемый FOXO4-DRI, нарушает взаимодействие FOXO4 с p53. В стареющих клетках это вызывает транслокацию p53 из ядра, что приводит к развитию апоптоза [ 73 ].
Было обнаружено, что пептиды AED и EDL регулируют экспрессию маркера апоптоза p53 в культурах почечных клеток во время старения [ 74 ]. Кроме того, пептиды AcSDKP, KED, AEDG и AED замедляют апоптоз и стимулируют пролиферацию клеток кожи, а также повышают функциональную активность фибробластов кожи и нормализуют гемостаз внутриклеточного матрикса [ 75 ]. Было установлено, что пептид AB-9 стимулирует пролиферативную активность и дифференцировку тимоцитов, а также подавляет апоптоз клеток тимуса [ 76 ].
С увеличением числа делений мезенхимальные стволовые клетки вступают в стадию старения, которая характеризуется изменением типичной морфологии их веретенообразной формы. Такие клетки становятся непригодными для клинического применения, где требуется большое количество стволовых клеток. Было обнаружено, что AEDG и KED снижают экспрессию генов и синтез белков репликативного старения p16 и p21 в культурах стволовых клеток периодонтальной связки и в мезенхимальных стволовых клетках десны человека [ 21 ].
Также было обнаружено, что короткие пептиды AED, KED и KE модулируют экспрессию генов клеточного старения IGF1, FOXO1, TERT, TNKS2 и NFκB в мезенхимальных стволовых клетках костного мозга (линия FetMSC) в различных моделях клеточного старения [ 18 ].
Таким образом, короткие пептиды могут регулировать функциональную активность клеток в случае старения. Это позволяет использовать короткие пептиды в качестве регуляторов регенеративных процессов, а также для обеспечения дополнительных компонентов в культуральных средах, способных поддерживать функциональное состояние клеточного материала во время заместительной терапии возрастных заболеваний.
4. Взаимодействие коротких пептидов с ДНК и гистоновыми белками.
В современной литературе пептид-модифицированная регуляция экспрессии генов объясняется взаимодействием пептидов с ДНК [ 23 , 24 ]. Например, в упомянутом выше обзоре [ 30 ] описание механизма биологических эффектов пептидов затрагивает лишь их способность регулировать экспрессию генов. В то же время, как уже отмечалось ранее, экспрессия генов может регулироваться различными механизмами: метилированием ДНК и/или ацетилированием гистонов, а также факторами транскрипции [ 27 ]. Далее авторы рассмотрят механизмы взаимодействия пептидов с ДНК и гистонами, чтобы объяснить специфичность биологического действия пептидов.
4.1. Короткие пептиды + ДНК
Важно отметить ряд экспериментальных физико-химических исследований, указывающих на возможность связывания коротких пептидов с ДНК. Следует подчеркнуть, что обычно ДНК существует в виде двойной спирали, тогда как ее транскрипция и репликация требуют разделения двухспиральных нитей, и что это также может быть достигнуто путем воздействия температуры 69,5 °C. Ченг и др., используя замещение бромидом этидия и гель-электрофорез, исследовали способность синтезированных циклических и линейных коротких пептидов связываться с ДНК и расщеплять ее (при температурах ниже 60 °C). Авторы пришли к выводу, что тетрапептид цикло[Lys-Trp-Lys-Ahx-] является перспективным агентом для расщепления ДНК, поскольку он имеет лучшие константы связывания и расщепления нуклеиновых кислот по сравнению со своим линейным аналогом и пептидом цикло[Lys-Tyr-Lys-Ahx-] [ 77 ].
Другое исследование ДНК в растворе продемонстрировало ее разделение на отдельные нити при добавлении короткого пептида AEDG, причем это происходило при температуре 28 °C, характеризующейся нейтральным pH и приблизительно двукратным уменьшением индексов энтропии и энтальпии [ 78 ].
Следующая группа исследований использовала различные методы для анализа природы связывания коротких пептидов с ДНК. Спектроскопия кругового дихроизма показала, что пептидный димер KGVCV-N2H2Dns2 может взаимодействовать с олигонуклеотидами. Вероятность такого взаимодействия и стабильность комплексов к возрастающим концентрациям NaCl уменьшаются в следующем порядке: поли-dG, поли-dC, поли-dA, поли-dT, поли-dGC, поли-dGC. Константа ассоциации пептид-олигонуклеотидного комплекса в 20 раз выше для последовательностей поли-dG и поли-dC, чем для поли-dA и поли-dT [ 79 ].
Другое исследование с использованием методов молекулярного моделирования проанализировало способность всех 400 вариантов дипептидов (все возможные комбинации 20 стандартных аминокислот) связывать все возможные комбинации двухцепочечных ДНК-тетрануклеотидов (дцДНК) в классической B-форме. Среди всех вариантов было выявлено 57 дипептидов с высокой селективностью связывания с дцДНК [ 80 ]. Авторы отметили, что блокирование на концах дипептидов стандартными кэпирующими группами N-(CH3-CO-NH-) и C-(-CO-NH2) повышает эффективность связывания. Следует подчеркнуть, что иммунопротекторный пептид KE, упомянутый ранее в этом обзоре и входящий в состав препарата Тималин, показал наилучшие параметры связывания с последовательностью дцДНК TCGA среди всех дипептидов со свободными концами ( рис. 2 ). В более раннем исследовании с использованием методов молекулярной динамики и молекулярного докинга также было показано, что аминокислоты, входящие в состав пептида KE, могут дополнительно взаимодействовать с двухцепочечной ДНК ( рис. 2 ). Однако энергия взаимодействия двухцепочечной ДНК с пептидом выше, чем с отдельными аминокислотами. Это позволило авторам сделать вывод, что пептидные связи усиливают взаимодействие пептида KE с двухцепочечной ДНК [ 81 ].
Рисунок 2. Классическое B-образное связывание дипептида KE с областью «TCGA» двухцепочечной ДНК. Измерение проводилось методом молекулярного моделирования и докинга лигандов с использованием программного обеспечения ICM-Pro (Molsoft LLC, Сан-Диего, Калифорния, США).
Аминокислоты, несущие заряды на своих боковых группах, могут связываться с двухцепочечной ДНК и изменять прочность двойной спирали. Измерение температуры плавления двухцепочечной ДНК (Tm) показало, что кислые аминокислоты (глутаминовая кислота, аспарагиновая кислота) ослабляют водородные связи между нитями двухцепочечной ДНК, в то время как основные аминокислоты (аргинин, лизин) усиливают взаимодействие между нитями. Наблюдается ранговая корреляция между изоэлектрическими точками аминокислот и изменениями Tm. Аналогичная зависимость гиперхромного эффекта от изоэлектрической точки белков (пепсина, инсулина, кортексина и протамина) была обнаружена для комплексов двухцепочечная ДНК-белок при комнатной температуре. Короткие пептиды KE, AEDG и KEDP, содержащие смесь кислых и основных аминокислотных остатков, также влияют на Tm и стабильность двухцепочечной ДНК. Было обнаружено, что Glu в своей нескрученной форме связывается с большой бороздкой dsDNA и разрушает 3 водородные связи, тем самым дестабилизируя dsDNA. Напротив, Lys в своей нескрученной форме связывается с внешней поверхностью dsDNA и образует две связи с атомами кислорода соседних фосфодиэфирных групп, тем самым стабилизируя структуру dsDNA [ 82 ].
Взаимодействие нейропротекторного пептида EDR, входящего в состав препарата Кортексин, с dsDNA изучалось с помощью ядерного магнитного резонанса, вискометрии и молекулярной динамики. Установлено, что EDR может взаимодействовать с большой бороздкой dsDNA, образуя связи с атомами N7 и O6 гуанина. Ионы Mg2 + усиливают связывание EDR с dsDNA благодаря своей способности экранировать отрицательно заряженные фосфатные группы dsDNA [ 83 ]. Аналогичный механизм связывания с dsDNA был установлен для AEDL, бронхопротекторного пептида [ 41 ].
Короткие пептиды AEDG, EDR, AEDL, KEDG, AEDR и KEDW либо ингибируют, либо стимулируют гидролиз ДНК бактериофага λ с помощью эукариотических эндонуклеаз WEN1 и WEN2 в зависимости от состояния метилирования ДНК. Таким образом, пептиды могут не только идентифицировать специфические последовательности ДНК, но и их статус метилирования. Помимо взаимодействия с двухцепочечной ДНК, у эукариот пептиды могут связываться с олигонуклеотидами, содержащими NG- и CG-сайты, когда они метилированы [ 84 ].
Пептидный мотив SPKK в белках, регулирующих экспрессию генов, может связываться с малой бороздкой двухцепочечной ДНК. Этот пептидный мотив был связан с противоопухолевым препаратом Амсакрином для усиления его взаимодействия с двухцепочечной ДНК. Были разработаны и синтезированы две бифункциональные молекулы, в которых производное амсакрина-4-карбоксамида было связано либо с одним, либо с двумя мотивами SPKK с 2-аминопропильным ядром. Оба пептидных конъюгата взаимодействуют с большой и малой бороздками двухцепочечной ДНК. На этот процесс не влияет взаимодействие двухцепочечной ДНК с гистонами [ 85 , 86 ]. Однако вероятность связывания октапептида SPKKSPKK с малой бороздкой двухцепочечной ДНК зависит от (не)доступности гистоновых белков [ 87 ]. Связывание пептидного мотива SPKK с интеркалирующими препаратами оказывается эффективной системой стабилизации комплексов препарат-ДНК.
Предполагается, что короткие пептиды, полученные из хромосомных белков, специфически связываются с малой бороздкой двуцепочечной ДНК в участках, богатых поли-А- и поли-Т-последовательностями [ 88 ]. Связывание ДНК A- и T-специфических мотивов двуцепочечной ДНК с пептидом SPRKSPRK было исследовано с помощью ЯМР-спектроскопии. Было обнаружено, что пептид SPRKSPRK неспецифически взаимодействует с последовательностями двуцепочечной ДНК CGCAAAAAAGGC и GCCTTTTTTGCG. В этом случае пептиды TPKRPRGRPKK, PRGRPKK и PRGRP, полученные из негистонового хромосомного белка HMG-I/Y, специфически связываются с участками двуцепочечной ДНК CGCAAATTTGCG и CGCGAATTCGCG. Фрагмент RGR каждого пептида контактирует с малой бороздкой двуцепочечной ДНК вдоль боковых цепей аргинина [ 89 ]. Исследователи считают, что наличие аргинина в коротких пептидах важно для их специфического связывания с любой частью малой бороздки двухцепочечной ДНК, содержащей поли-А и поли-Т последовательности. В другом исследовании было выявлено взаимодействие короткого пептидного фрагмента из белка bZIP с богатыми А/Т олигонуклеотидами. Этот пептидный фрагмент стабилизирует структуру олигонуклеотида [ 90 ].
В литературе мало источников, связанных с попытками определить назначение сайтов связывания пептидов с ДНК. Недавно Этцион-Фукс и др. опубликовали отчет о новом ансамблевом методе машинного обучения dSPRINT, который предлагает, среди широкого спектра своих задач, характеристику молекулярных функций белковых доменов, связывающихся с нуклеиновыми кислотами, ионами и пептидами, а также ассоциацию этих доменов с геномом человека [ 91 ]. Несмотря на то, что этот алгоритм предназначен для анализа взаимодействия большого белкового домена с ДНК и другими лигандами, вероятно, этот подход может быть адаптирован для использования с короткими пептидами.
Нельзя исключить возможность того, что идентифицированная нуклеотидная последовательность в ДНК, к которой связывается короткий пептид, может принадлежать к промоторной области генов, демонстрирующих пептид-регулируемую экспрессию. В этом контексте следует обратить внимание на исследования, в которых были идентифицированы специфические промоторы генов человека, к которым связываются короткие пептиды. В недавнем исследовании с использованием методов молекулярной динамики было продемонстрировано, что нейропротекторный пептид EDR взаимодействует с последовательностью двухцепочечной ДНК, идентифицированной в промоторных областях генов, участвующих в патогенезе болезни Альцгеймера (CASP3, TP53, SOD2, GPX1, PPARA, PPARG, NES, GAP43, SUMO1, APOE и IGF1) [ 61 ]. Этот результат позволил авторам определить механизм нейропротекции этим пептидом.
Изучение свойств пептида KEDW с помощью УФ-спектроскопии, кругового дихроизма и молекулярного моделирования показало, что этот тетрапептид связывается с ДНК в ассоциации с последовательностью ACCT, которая находится в промоторных областях генов, ответственных за функциональное состояние клеток поджелудочной железы. Авторы использовали этот результат для объяснения ранее выявленных свойств тетрапептида [ 42 ].
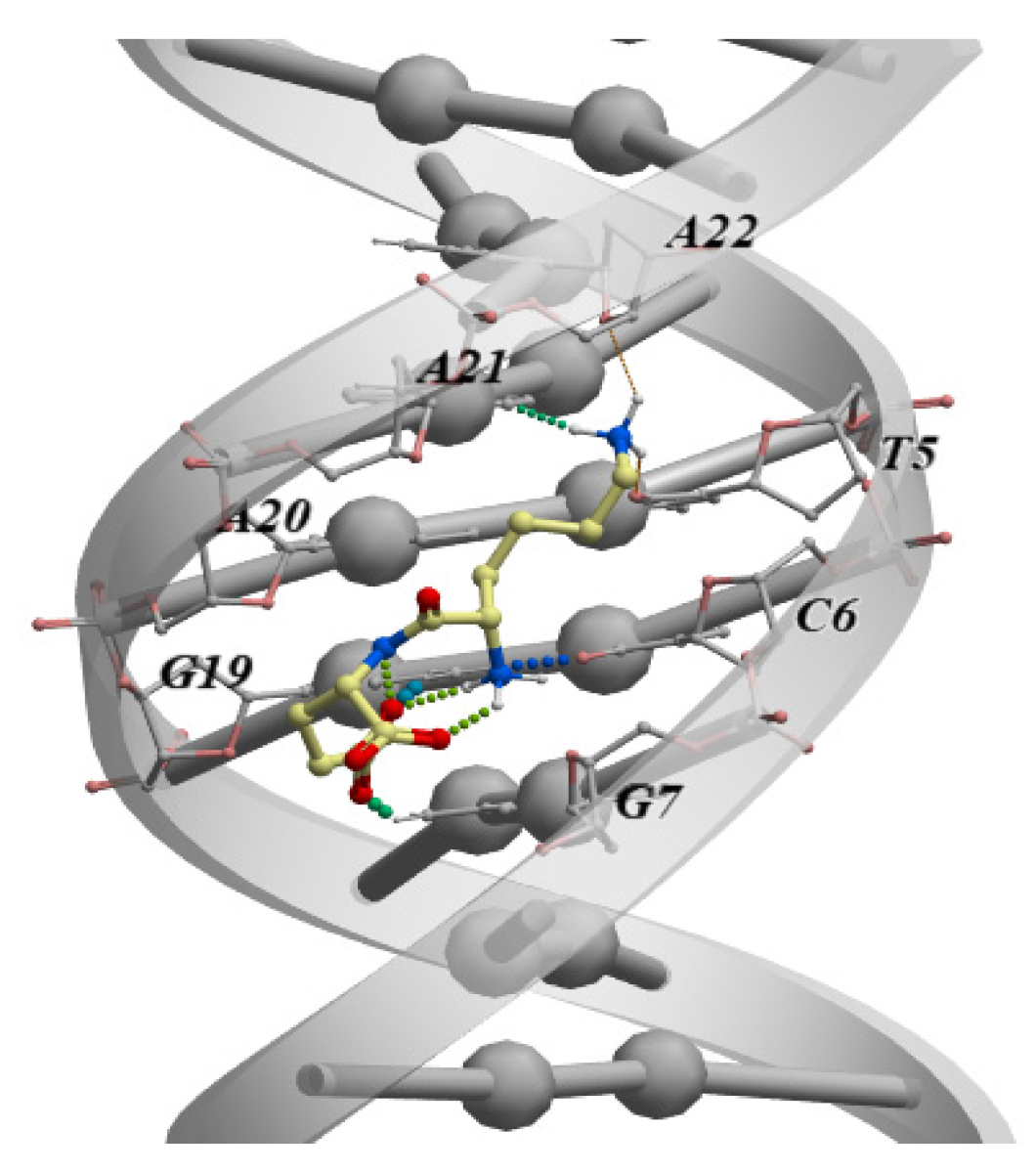
Вышеупомянутый анализ связывания дипептидов с двухцепочечной ДНК выявил специфическую нуклеотидную последовательность двухцепочечной ДНК TCGA, которая связывается с пептидом KE в промоторе гена APG5L ( рис. 3 ).
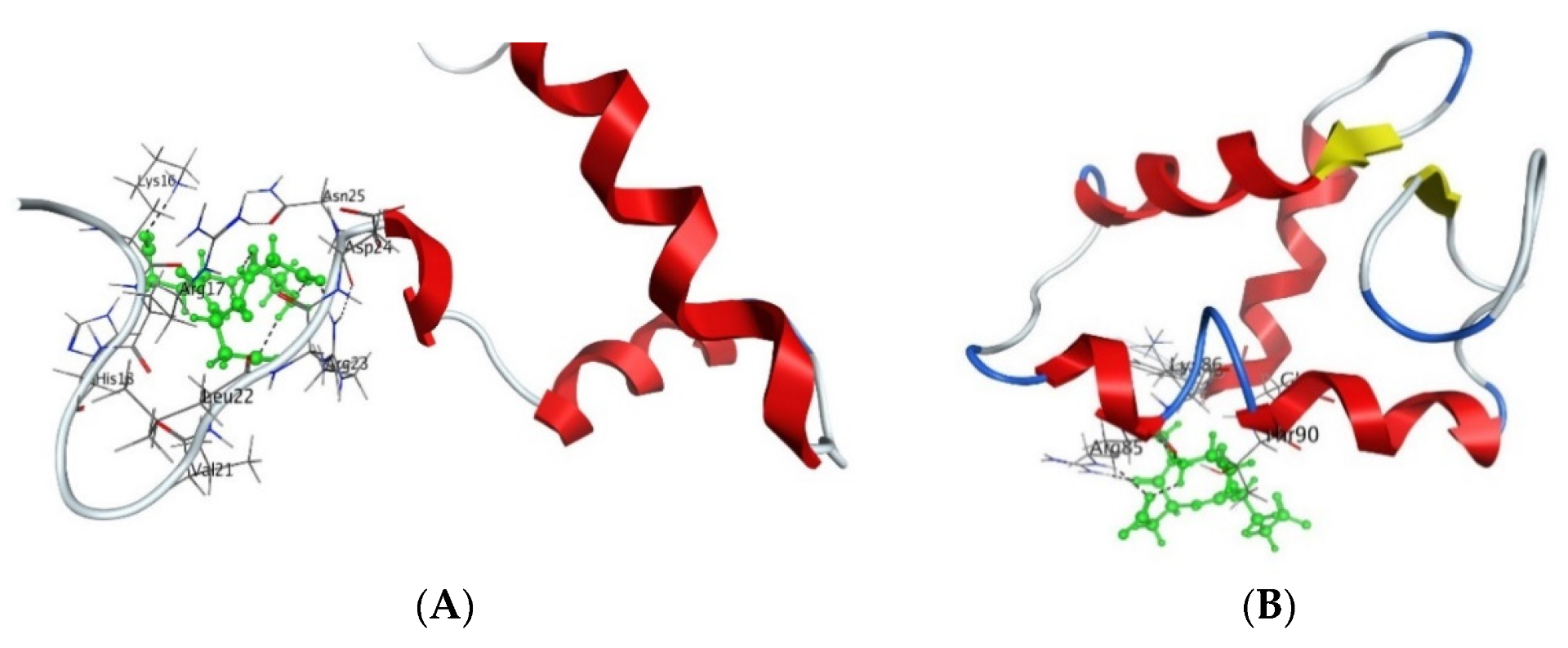
Рисунок 3. Взаимодействие пептида AEDG с гистоном H4 ( A ) и гистоном H1/6 ( B ) в соответствии с данными, полученными с помощью молекулярного моделирования с использованием силового поля (Molecular Operating Environment, силовое поле Amber12EHT). Молекулы гистонов (Банк данных белков) изображены в виде α-спиральных доменов и петель. Атомы кислорода показаны красным, атомы азота — синим, атомы углерода — черным, а атомы водорода — светло-серым. Пептид выделен зеленым цветом. Пунктирная линия показывает водородные связи.
Следует отметить, что в исследовании in vitro пептид KE регулировал экспрессию этого гена ( таблица 2 ), и это коррелирует с результатами молекулярного моделирования. Аналогичные исследования были проведены для пептида EW ( таблица 4 ).
Таблица 4. Промоторы генов человека, в которых обнаружена нуклеотидная последовательность двуцепочечной ДНК, к которой связывается пептид EW.
| Промоторы генов | Нуклеотидная последовательность |
|---|---|
| 1 АТФ- промотор | GGGCGGGGGCAACGGTCACCTGATCTGCGGCTGTCGAGGCCGCTGAGGCAGT GGAG GCTG |
| 2 АТФ- промотор | CAGCTGTCCCAGCGGAAGCGACGAAGGGACGGGACCCG GGAG CCTGGAGTCCGAGCG |
| 1 Промотор MT-CO1 | CGGGC GGAG TCTTCCTCGATCCCGTGGTGCTCCGCGGCGCGGCCTTGCTCTCTTCCGGTC; |
| 2 MT-CO1 промотор | CATTAACGGGAACAAATTCTCTTTACACAAAGCTCAGGCACATTCAATCAAGG GGAG CCA |
| 3 MT-CO1 промотор | GCCCCCGCCCGCTCC GGAG CAACCCGCGAGCTTACACCGGCTTCTCTCTGTCCTCAGCCC |
| 4 MT-CO1 промотор | GTGATTGGCCCAGAGAGG GGAG GTGACCCCAGGCCCAGGAAAG GGAG CGAGGACAGCGC |
| промотор HBA1 | GAGTATGGTGC GGAG GCCCT GGAG AGGTGAGGCTCCCTCCCCTGCTCCGACCCGGGCTCC |
| промотор HSP90 | TTCCAGATGCCTGAGGAAACCCAGACCCAAGACCAACCGAT GGAG GA GGAG GAGGTTGAG |
База данных промоторов Homo sapiens (человека) взята из hsEPDnew ( https://epd.epfl.ch/human/human_database.php?db=human , дата доступа: 1 октября 2019 г.). Последовательности нуклеотидов, с которыми связывается пептид, выделены красным цветом.
Молекулярное моделирование показало, что дипептид EW связывается с dsDNA в классической B-форме в соответствии с наличием нуклеотидной последовательности GGAG. Эта нуклеотидная последовательность была идентифицирована в 2 промоторах гена ATP , в 4 промоторах гена MT-CO1 , а также в промоторах генов HBA1 и HSP90 , причем экспрессия всех этих генов регулируется этим пептидом в экспериментах in vitro ( таблица 1 и таблица 2 ) [ 42 ].
Таким образом, данный обзор является первой работой, прослеживающей взаимосвязь физико-химических, молекулярно-моделирующих и молекулярно-биологических исследований. Систематизация проанализированных результатов впервые позволила идентифицировать механизм пептидной регуляции экспрессии генов на уровне взаимодействия с ДНК. Согласованность между вышеупомянутыми исследованиями можно рассматривать как подтверждение ранее выдвинутой гипотезы о том, что короткие пептиды оказывают широкий спектр биологических эффектов посредством взаимодействия ДНК-пептид и регуляции экспрессии генов, ответственных за функциональное состояние человеческого организма.
4.2. Короткие пептиды + белки гистонов
Современные представления о регуляции экспрессии генов невозможны без понимания эпигенетических механизмов, основными компонентами которых являются гистоновые белки. Гистоны — это ядерные белки, обеспечивающие упаковку нитей ДНК внутри ядра. Изучение взаимодействия коротких пептидов с такими гистоновыми белками является важным дополнением к пониманию механизмов их взаимодействия с ДНК и регуляции экспрессии генов.
Была продемонстрирована способность коротких пептидов высвобождать гены [ 92 ], подавленные в результате гетерохроматинизации эухроматических областей хромосом, которая происходит во время старения [ 93 ]. В другом исследовании было показано, что аминокислоты, а также дипептиды и трипептиды могут взаимодействовать с клеточным хроматином [ 94 ].
Анализ тушения флуоресценции показал, что короткие пептиды AEDG, EDR, AEDL, KEDG, AEDR и KEDW связываются с FITC-мечеными гистонами пшеницы H1, H2B, H3 и H4 ( рис. 3 ) в области мотивов связывания пептидов N-концевых участков. Авторы указывают, что пептиды с разными зарядами могут связываться с разными мотивами: например, аминокислотная последовательность kaakakk служит мотивом для пептидов AEDL и AEDG, тогда как evaa выполняет соответствующую функцию для пептидов, содержащих остатки лизина или аргинина. Следует подчеркнуть, что авторы сообщили, что ДНК и олигонуклеотиды в сочетании с гистонами могут усиливать или предотвращать связывание пептидов [ 15 ].
Молекулярное моделирование показало, что нейропротекторные пептиды EDR и DS могут связываться с гистоном H1.3. Авторы предполагают, что такое связывание может влиять на конформацию гистона H1.3 и приводить к модификации структуры хроматина в локусах определенных генов, в частности, Fkbp1b , который кодирует белок, связывающий FK506. Ген Fkbp1b кодирует пептидил-пролил цис-транс-изомеразу, которая регулирует высвобождение ионов кальция из саркоплазматического и эндоплазматического ретикулума нейронов. Активация транскрипции гена Fkbp1b с помощью EDR или DS, следовательно, может позволить синтез его белкового продукта и, таким образом, высвобождение ионов кальция из саркоплазматического и эндоплазматического ретикулума обработанных нейронов [ 95 ]. Другое исследование показало, что пептид AEDG может взаимодействовать с гистонами H1/6 и H1/3 через аминокислотные последовательности His-Pro-Ser-Tyr-Met-Ala-His-Pro-Ala-Arg-Lys и Tyr-Arg-Lys-Thr-Gln, которые взаимодействуют с ДНК. Авторы связывают это свойство пептида с его влиянием на экспрессию нейрогенетических генов [ 17 , 20 ]. Таким образом, можно проследить эпигенетический механизм регуляции функциональной активности нейронов пептидом.
Таким образом, сайт-специфические взаимодействия коротких пептидов с гистоновыми белками могут служить механизмами эпигенетического контроля хроматина. Недавние исследования указывают на необходимость всестороннего анализа взаимодействия коротких пептидов с ДНК и гистонами для выявления механизмов регуляции экспрессии генов и функциональной активности клеток в организме человека.
5. Выводы
Разнообразный спектр биологических эффектов коротких пептидов, обеспечивающих контроль ключевых процессов в организме, указывает на важность изучения механизмов их действия ( таблица 5 ).
Таблица 5. Биологические эффекты коротких пептидов.
| Н | Структура и название пептида | Биологическая активность | Ссылки |
|---|---|---|---|
| Полифункциональные пептиды | |||
| 1 | AED, Карталакс | регуляция функций хрящевых и кожных фибробластов, дифференцировка нейронных клеток | [ 17 , 18 , 21 , 34 , 35 , 74 ] |
| 2 | AEDG, Эпиталон | регуляция нейроиммуноэндокринной функции, регуляция циркадного ритма, защитный эффект для сетчатки, антиоксидантный эффект, стресс-защитный эффект, геронтопротекция, активация функции фибробластов кожи, дифференцировка растительных клеток, связывание ДНК | [ 15 , 16 , 19 , 21 , 23 , 34 , 40 , 51 , 78 , 82 , 84 ] |
| 3 | AEDL, Бронхоген | регуляция функции и дифференцировки клеток легких, дифференцировка растительных клеток, связывание ДНК | [ 15 , 16 , 24 , 35 , 41 , 84 ] |
| 4 | EDL, Оваген | регуляция функции почечных клеток, гепатопротекция, связывание ДНК | [ 74 ] |
| 5 | EDR, Пинеалон | нейропротекция, активация нейрональной дифференцировки стволовых клеток, антиоксидантный эффект, связывание ДНК | [ 15 , 61 , 83 , 84 , 95 ] |
| 6 | EW, Тимоген | лекарственное средство, регуляция функции иммунной системы, антиоксидантный эффект, стресс-защитный эффект, геронтопротекция, связывание с ДНК | [ 23 , 42 ] |
| 7 | КЕ, Вилон | регуляция функции иммунной системы, антиоксидантный эффект, стресс-защитный эффект, геронтозащита, активация нейрональной дифференцировки стволовых клеток, активация дифференцировки растительных клеток, связывание ДНК | [ 16 , 17 , 18 , 21 , 23 , 34 , 35 , 81 , 82 ] |
| 8 | KED, Весуген | регуляция функции сердечно-сосудистой системы, нейропротектор, активация нейрональной дифференцировки стволовых клеток, активация функции фибробластов кожи, геронтопротекция, связывание ДНК | [ 17 , 18 , 21 , 22 , 34 , 35 , 60 , 75 ] |
| 9 | КЛДЛ | остеогенная и хондрогенная дифференцировка стволовых клеток | [ 37 ] |
| 10 | РАБОТА | остеогенная и хондрогенная дифференцировка стволовых клеток | [ 37 ] |
| Монофункциональные пептиды | |||
| 11 | AEDR, Кардиоген | регуляция функций сердечно-сосудистой системы | [ 15 , 84 ] |
| 12 | RADA в сочетании с Jagged1 | дифференцировка клеток-предшественников сердца | [ 37 ] |
| 13 | KEDG, Тестаген | регуляция функций мужской репродуктивной системы | [ 15 , 34 , 35 ] |
| 14 | ГГ ... | нейропротекция | [ 35 , 40 ] |
| 15 | MEHFPGP, Semax | лекарственное средство, нейропротекция | [ 53 , 54 , 55 , 56 , 57 ] |
| 16 | TKPRPGP | нейропротекция | [ 58 , 59 ] |
| 17 | ИКВАВ | нейрональная дифференциация стволовых клеток | [ 36 ] |
| 18 | ИРВ | остеогенная дифференцировка стволовых клеток | [ 35 , 43 ] |
| 19 | ГРГДС | остеогенная дифференцировка стволовых клеток | [ 35 , 44 , 45 ] |
| 20 | YCWSQYLCY | остеогенная дифференцировка стволовых клеток | [ 46 ] |
| 21 | AcSDKP | активация функции фибробластов кожи | [ 75 ] |
| 22 | TKPRPGP | иммунозащита | [ 58 , 59 ] |
| 23 | Ac-SHAVSS-NH2, HAV | регуляция экспрессии генов, участвующих в синтезе Е-кадгерина | [ 52 ] |
| Пептиды с неизвестной биологической функцией | |||
| 24 | цикло[Лиз-Трп-Лиз-Ахх-] | связывание ДНК | [ 77 ] |
| 25 | пептидный димер KGVCV-N2H2Dns2 | связывание ДНК | [ 79 ] |
| 26 | ПРГРП | связывание ДНК | [ 89 ] |
| 27 | PRGRPKK | связывание ДНК | [ 89 ] |
| 28 | РГР | связывание ДНК | [ 89 ] |
| 29 | СПКК | связывание ДНК | [ 85 , 86 , 87 ] |
| 30 | СПРКСПРК | связывание ДНК | [ 89 ] |
| 31 | TPKRPRGRPKK | связывание ДНК | [ 89 ] |
Многочисленные исследования показали, что основным механизмом действия таких пептидов, вероятно, является их способность регулировать экспрессию генов и синтез белка. В данном обзоре основное внимание уделено всестороннему анализу возможного механизма регуляции экспрессии генов посредством взаимодействия этих коротких пептидов с ДНК ( таблица 5 ).
Короткие пептиды регулируют экспрессию широкого спектра генов, связанных с различными типами функциональной активности клеток и с разнообразными биологическими процессами: энергетическим гомеостазом, клеточным стрессом, апоптозом и т. д. Более того, пептиды могут регулировать физиологическую активность клеток в случае старения. Таким образом, пептиды могут быть использованы для поддержания функционального состояния клеток при лечении возрастных заболеваний.
В обзоре представлена информация о генах и белках, участвующих в развитии таких патологий, как иммунодефицит, различные виды нейропатий и онкологические заболевания. Было установлено, что пептиды регулируют экспрессию генов, участвующих в патогенезе конкретных заболеваний. Это указывает на многообещающие перспективы использования коротких пептидов в качестве физиологически активных компонентов лекарственных препаратов.
Важным аспектом изучения механизма действия пептидов стал анализ связывания дипептидов с ДНК, что внесло значительный вклад в идентификацию специфических последовательностей ДНК. Эти последовательности можно обнаружить в промоторных областях генов, экспрессия которых регулируется этими короткими пептидами. Молекулярное моделирование, а также физико-химические методы позволили установить связывание коротких пептидов с гистонами, что открывает потенциал для модификации структуры хроматина.
Данный систематический обзор выявил сходство результатов многочисленных исследований, проведенных с использованием методов молекулярной биологии, физических и химических методов, а также биоинформатики. Несомненно, необходимы дальнейшие исследования для расширения нашего понимания молекулярно-генетических механизмов регуляции пептидов.
Однако даже на данном этапе мы можем с уверенностью предсказать, что существует общий механизм пептидной регуляции экспрессии генов и синтеза белка, зависящий от взаимодействия ДНК-пептид.
Вклад авторов
Разработка концепции: ВКК; Формальный анализ: АРИ; Подготовка первоначального варианта текста: НСЛ, ЭСМ, ИГП и АРИ; Рецензирование и редактирование текста: ИГП и НСЛ; Визуализация: ЭСМ и НСЛ. Все авторы ознакомились с опубликованной версией рукописи и согласились с ней.
Финансирование
Данное исследование не получало внешнего финансирования.
Заявление этического комитета
Непригодный.
Заявление о согласии на информированное согласие
Непригодный.
Заявление о доступности данных
Непригодный.
Благодарности
Непригодный.
Конфликты интересов
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Апостолопулос, В.; Боярска, Дж.; Чай, ТТ; Эльнагди, С.; Качмарек, К.; Мацукас, Дж.; Нью, Р.; Паранг, К.; Лопес, ОП; Пархиз, Х.; и др. Глобальный обзор коротких пептидов: границы и перспективы. Molecules 2021 , 26 , 430. [ Google Scholar ] [ CrossRef ]
- Совместная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN). Номенклатура и символика аминокислот и пептидов. Eur. J. Biochem. 1984 , 138 , 9–37. [ Google Scholar ] [ CrossRef ]
- Нельсон, Д.; Кокс, М. Ленингер. Принципы биохимии , 4-е изд.; Фриман и компания: Нью-Йорк, штат Нью-Йорк, США, 2005; с. 1216. [ Google Scholar ]
- Хоффкнехт, Б.К.; Ворм, Д.Дж.; Боберски, С.; Прохнов, П.; Бандов, Дж.Е.; Метцлер-Нольте, Н. Влияние мультивалентности ультракоротких антимикробных пептидов (АМП) на основе аргинина и триптофана на их антибактериальную активность. ChemMedChem 2015 , 10 , 1564–1569. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ни, М.; Трессет, Г.; Илиеску, К.; Хаузер, CAE Ультракороткие пептидные тераностические наночастицы, полученные методом быстрого обмена растворителей с помощью микрофлюидики. IEEE Trans NanoBiosci. 2020 , 19 , 627–632. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Абуине, Р.; Ратнайаке, А.У.; Бюн, Х.Г. Биологическая активность пептидов, очищенных из гидролизатов рыбьей кожи. Fish Aquat. Sci. 2019 , 22 , 10. [ Google Scholar ] [ CrossRef ][ Green Version ]
- Чочиола, Т.; Джовати, Л.; Конти, С.; Мальяни, В.; Сантиноли, К.; Полонелли, Л. Природные и синтетические пептиды с противогрибковой активностью. Future Med. Chem. 2016 , 8 , 1413–1433. [ Google Scholar ] [ CrossRef ]
- Хавинсон, ВК. Пептидные лекарства: прошлое, настоящее, будущее. Клин. Мед. 2020 , 98 , 165–177. [ Google Scholar ] [ CrossRef ]
- Ли, AC; Харрис, JL; Ханна, KK; Хонг, JH. Комплексный обзор современных достижений в разработке и дизайне пептидных лекарственных препаратов. Int. J. Mol. Sci. 2019 , 20 , 2383. [ Google Scholar ] [ CrossRef ][ Green Version ]
- Морозов, В.Г.; Хавинсон, В.К. Природные и синтетические тимусные пептиды как терапевтические средства при иммунной дисфункции. Международный журнал иммунофармакотерапии. 1997 , 19 , 501–505. [ Google Scholar ] [ CrossRef ]
- Морозов, В.Г.; Хавинсон, В.К. Новый класс биологических регуляторов многоклеточных систем: цитомедины. Биол. Вест. Рев. 1983 , 96 , 339–352. (На русском языке) [ Google Scholar ]
- Морозов, В.Г.; Хавинсон, В.К. Роль клеточных медиаторов (цитомединов) в регуляции генетической активности. Изв. Акад. Наук СССР Биол. 1985 , 4 , 581–587. (На русском языке) [ Google Scholar ]
- Хавинсон, ВК; Малинин, ВВ; Чалисова, НИ; Григорьев, ЕИ. Тканеспецифическое действие пептидов в культуре тканей крыс разного возраста. Adv. Gerontol. 2002 , 9 , 95–100. [ Google Scholar ] [ PubMed ]
- Анисимов, В.Н.; Хавинсон, В.К. Пептидная биорегуляция старения: результаты и перспективы. Биогеронтология 2010 , 11 , 139–149. [ Google Scholar ] [ CrossRef ]
- Федореева, ЛИ; Смирнова, ТА; Коломийцева, ГЮ; Хавинсон, ВК; Ванюшин, БФ. Взаимодействие коротких пептидов с FITC-мечеными гистонами пшеницы и их комплексами с дезоксирибоолигонуклеотидами. Биохимия 2013 , 78 , 166–175. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Fedoreyeva, L.I.; Dilovarova, T.A.; Ashapkin, V.V.; Martirosyan, Y.T.; Khavinson, V.K.; Kharchenko, P.N.; Vanyushin, B.F. Short Exogenous Peptides Regulate Expression of CLE, KNOX1, and GRF Family Genes in Nicotiana tabacum. Biochemistry 2017, 82, 521–528. [Google Scholar] [CrossRef]
- Капути, С.; Трубиани, О.; Синджари, Б.; Трофимова, С.; Диомеде, Ф.; Линкова, Н.; Дятлова, А.; Хавинсон, В. Влияние коротких пептидов на нейрональную дифференцировку стволовых клеток. Международный журнал иммунопатологии и фармакологии. 2019 , 33 , 1–12. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Green Version ]
- Ашапкин, В.; Хавинсон, В.; Шиловский, Г.; Линкова, Н.; Вануйшин, Б. Экспрессия генов в культурах стареющих мезенхимальных стволовых клеток человека: модуляция короткими пептидами. Mol. Biol. Rep. 2020 , 47 , 4323–4329. [ Google Scholar ] [ CrossRef ]
- Ивко, О.М.; Линкова, Н.С.; Илина, А.Р.; Шарова, А.А.; Рыжак, Г.А. Пептид AEDG регулирует экспрессию генов циркадных ритмов человека при ускоренном старении шишковидной железы. Adv. Gerontol. 2020 , 33 , 429–435. [ Google Scholar ]
- Хавинсон, В.; Диомеде, Ф.; Миронова, Е.; Линкова, Н.; Трофимова, С.; Трубиани, О.; Капути, С.; Синджари, Б. Пептид AEDG (Эпиталон) стимулирует экспрессию генов и синтез белка во время нейрогенеза: возможный эпигенетический механизм. Molecules 2020 , 25 , 609. [ Google Scholar ] [ CrossRef ][ Green Version ]
- Синджари, Б.; Диомеде, Ф.; Хавинсон, В.; Миронова, Е.; Линкова, Н.; Трофимова, С.; Трубиани, О.; Капути, С. Короткие пептиды защищают стволовые клетки полости рта от старения. Stem Cell Rev. Reps. 2020 , 16 , 159–166. [ Google Scholar ] [ CrossRef ]
- Хавинсон, ВК; Линкова, НС; Умнов, РС. Пептид KED: молекулярно-генетические аспекты регуляции нейрогенеза при болезни Альцгеймера. Бюллетень экспериментальной биологии и медицины, 2021 , 171 , 190–193. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Хавинсон, В.К.; Малинин, В.В. Геронтологические аспекты регуляции пептидов генома ; Karger AG: Базель, Швейцария, 2005; стр. 1–104. [ Google Scholar ]
- Ванюшин, Б.Ф.; Хавинсон, В.К. Эпигенетика — иной взгляд на генетику ; Вальтер, Д., Бом, П., ред.; Springer: Шам, Швейцария, 2016; Глава 5; с. 69. [ Google Scholar ]
- Джанфранчески, Г.Л.; Амичи, Д.; Гульельми, Л. Доказательства наличия в тимусе теленка пептидного фактора, контролирующего транскрипцию ДНК in vitro. Biochim. Biophys. Acta 1975 , 414 , 9–19. [ Google Scholar ] [ CrossRef ]
- Гульельми, Л.; Джанфранчески, Г.Л.; Венанци, Ф.; Польцонетти, А.; Амичи, Д. Специфическое взаимодействие тимусных пептидов с ДНК. Корреляция с возможной стереохимической схемой изгиба ДНК. Mol. Biol. Rep. 1979 , 4 , 195–201. [ Google Scholar ] [ CrossRef ]
- Vakhitova, Y.V.; Sadovnikov, S.V.; Borisevich, S.S.; Ostrovskaya, R.U.; Gudasheva, T.A.; Seredenin, S.B. Molecular Mechanism Underlying the Action of Substituted Pro-Gly Dipeptide Noopept. Acta Nat. 2016, 8, 82–89. [Google Scholar] [CrossRef]
- Ченг, Р. К.; Нг, Т. Б.; Вонг, Дж. Х. Морские пептиды: биологическая активность и применение. Mar. Drugs 2015 , 13 , 4006–4043. [ Google Scholar ] [ CrossRef ]
- Павличевич, М.; Маэстри, Э.; Мармироли, М. Морские биоактивные пептиды — обзор их получения, структуры и применения с акцентом на пищевые источники. Mar. Drugs 2020 , 18 , 424. [ Google Scholar ] [ CrossRef ]
- Маэстри, Э.; Павличевич, М.; Монторси, М.; Мармироли, Н. Мета-анализ для корреляции структуры биоактивных пептидов в продуктах животного происхождения с учетом их эффекта и стабильности. Compr. Rev. Food Sci. Food Saf. 2019 , 18 , 3–30. [ Google Scholar ] [ CrossRef ][ Green Version ]
- Хавинсон, ВК; Кузник, БИ; Рыжак, ГА. Пептидные геропротекторы — эпигенетические регуляторы физиологической функции организма ; РГПУ имени А.И. Герцена: Санкт-Петербург, Россия, 2014; стр. 1–271. [ Google Scholar ]
- Виньо, Ф.; Герин, С.Л. Регуляция экспрессии генов: исследование взаимодействий ДНК-белок in vivo и in vitro. Expert Rev. Proteom. 2005 , 2 , 705–718. [ Google Scholar ] [ CrossRef ]
- Федореева, Л.И.; Киреев, И.И.; Хавинсон, В.К.; Ванюшин, Б.Ф. Проникновение коротких флуоресцентно-меченых пептидов в ядро клеток HeLa и специфическое взаимодействие пептидов с дезоксирибоолигонуклеотидами и ДНК in vitro. Биохимия 2011 , 76 , 1210–1219. [ Google Scholar ] [ CrossRef ]
- Хавинсон, В.; Линкова, Н.; Дятлова, А.; Трофимова, С. Пептидная регуляция клеточной дифференцировки. Обзор стволовых клеток. 2020 , 16 , 118–125. [ Google Scholar ] [ CrossRef ]
- Анисимов, С.В.; Бокелер, К.Р.; Хавинсон, В.К.; Анисимов, В.Н. Исследования влияния вилона и эпиталона на экспрессию генов в сердце мыши с использованием технологии ДНК-микроматриц. Бюллетень экспериментальной биологии и медицины, 2002 , 133 , 293–299. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Татман, П. Д.; Мухонен, Э. Г.; Викерс, С. Т.; Джи, А. О.; Ким, Э. С.; Ким, Д. Х. Самособирающиеся пептиды для стволовых клеток и тканевой инженерии. Biomater. Sci. 2016 , 4 , 543–554. [ Google Scholar ] [ CrossRef ] [ PubMed ][ Green Version ]
- Бупати, А.В.; Че, П.Л.; Сомасунтарам, И.; Фиоре, В.Ф.; Кабигас, Э.Б.; Бан, К.; Браун, М.Е.; Наруи, Й.; Баркер, Т.Х.; Юн, Ю.С.; и др. Модуляция функции сердечных клеток-предшественников посредством гидрогелево-зависимой активации Notch1. Biomaterials 2014 , 35 , 8103–8112. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Green Version ]
- Хеннесси, К.М.; Поллот, Б.Е.; Клем, У.К.; Фиппс, М.К.; Сойер, А.А.; Калпеппер, Б.К.; Беллис, С.Л. Влияние миметических пептидов коллагена I на адгезию и дифференцировку мезенхимальных стволовых клеток, а также на формирование костной ткани на поверхностях гидроксиапатита. Биоматериалы 2009 , 30 , 1898–1909. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Зеленая версия ]
- Канеда, Т.; Йошида, Х.; Накадзима, Ю.; Тоиси, М.; Нугрохо, А.Е.; Морита, Х. Циклолинопептиды, циклические пептиды из семян льна с ингибирующей активностью в отношении дифференцировки остеокластов. Bioorg. Med. Chem. Lett. 2016 , 1 , 1760–1761. [ Google Scholar ] [ CrossRef ]
- Ма, В.; Цзинь, Г.В.; Гехрет, П.М.; Чада, Н.К.; Су, В.Х. Новый клеточно-проникающий пептид для дифференцировки человеческих нейронных стволовых клеток. Biomolecules 2018 , 8 , 48. [ Google Scholar ] [ CrossRef ][ Green Version ]
- Khavinson, V.K.; Tendler, S.M.; Vanyushin, B.F.; Kasyanenko, N.A.; Kvetnoy, I.M.; Linkova, N.S.; Ashapkin, V.V.; Polyakova, V.O.; Basharina, V.S.; Bernadotte, A. Peptide regulation of gene expression and protein synthesis in bronchial epithelium. Lung 2014, 192, 781–791. [Google Scholar] [CrossRef]
- Khavinson, V.K.; Tendler, S.M.; Kasyanenko, N.A.; Tarnovskaya, S.I.; Linkova, N.S.; Ashapkin, V.V.; Yakutseni, P.P.; Vanyushin, B.F. Tetrapeptide KEDW Interacts with DNA and Regulates Gene Expression. Am. J. Biomed. Sci. 2015, 7, 156–169. [Google Scholar] [CrossRef]
- Шан, Н.; Бхуллар, Канзас ; Хаббард, БП; Ву, Дж. Трипептид IRW инициирует дифференцировку остеобластов по пути RUNX2. Биохим. Биофиз. Закон генерала Subj. 2019 , 1863 , 1138–1146. [ Академия Google ] [ CrossRef
- Яо, С.; Слэмович, Э.Б.; Вебстер, Т.Дж. Улучшение функций остеобластов на анодированном титане с нанотрубчатыми структурами. J. Biomed. Mater. Res. 2008 , 85 , 157–166. [ Google Scholar ] [ CrossRef ]
- Ким, Г.Х.; Ким, Л.С.; Пак, С.В.; Ли, К.; Юн, К.Д.; Ким, Х.С.; О, Г.Дж.; Джи, М.К.; Лим, Х.П. Оценка жизнеспособности и дифференцировки остеобластоподобных клеток на нанотрубках из диоксида титана, иммобилизованных пептидом Gly-Arg-Gly-Asp-Ser, посредством химической прививки. Журнал нанонауки. Нанотехнологии. 2016 , 16 , 1396–1399. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Оцуки, Ю.; Ии, М.; Мориваки, К.; Окада, М.; Уэда, К.; Асахи, М. Пептид W9 усиливает остеогенную дифференцировку стволовых клеток, полученных из жировой ткани человека. Biochem. Biophys. Res. Commun. 2018 , 495 , 904–910. [ Google Scholar ] [ CrossRef ]
- Дрёге, В. Свободные радикалы в физиологическом контроле клеточных функций. Physiol. Rev. 2002 , 82 , 47–95. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Юань, Ю. Механизмы, вдохновленные таргетными пептидами. Adv. Exp. Med. Biol. 2020 , 1248 , 531–546. [ Google Scholar ] [ CrossRef ]
- Ким, К.Х.; Сон, Дж.М.; Бенаюн, Б.А.; Ли, С. Митохондриально-кодируемый пептид MOTS-c перемещается в ядро для регуляции экспрессии ядерных генов в ответ на метаболический стресс. Cell Metab. 2018 , 28 , 516–524.e7. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Green Version ]
- Лю, Ф.; Цзинь, Т.; Дракер, Д.Дж. Экспрессия гена проглюкагона индуцируется гастрин-высвобождающим пептидом в линии энтероэндокринных клеток мыши. Эндокринология 1996 , 137 , 3710–3716. [ Google Scholar ] [ CrossRef ] [ Зеленая версия ]
- Хавинсон, В.; Попович, И. Препараты против старения: от фундаментальных исследований до клинической практики ; Вайзерман, А.М., ред.; Серия «Открытие лекарств» Королевского химического общества, № 57; Издательство Королевского химического общества: Лондон, Великобритания, 2017; Глава 20; стр. 496. [ Google Scholar ]
- Calcagno, AM; Fostel, JM; Reyner, EL; Sinaga, E.; Alston, JT; Mattes, WB; Siahaan, TJ; Ware, JA. Влияние пептида, полученного из E-кадгерина, на экспрессию генов клеток Caco-2. Pharm. Res. Rev. 2004 , 21 , 2085–2094. [ Google Scholar ] [ CrossRef ]
- Ставчанский, В.В.; Творогова, Т.В.; Боцина, А.И.; Лимборская, С.А.; Скворцова, В.И.; Миасоэдов, Н.Ф.; Дергунова, Л.В. Влияние семакса и его С-концевого пептида PGP на экспрессию нейротрофинов и их рецепторов в головном мозге крысы при неполной глобальной ишемии. Молекулярная биология, 2011 , 45 , 1026–1035. [ Google Scholar ]
- Медведева, Е.В.; Дмитриева, В.Г.; Поварова, О.В.; Лимборска, С.А.; Скворцова, В.И.; Мясоедов, Н.Ф.; Дергунова, Л.В. Влияние семакса и его С-концевого фрагмента Pro-Gly-Pro на экспрессию генов семейства VEGF и их рецепторов при экспериментальной очаговой ишемии головного мозга крысы. Журнал молекулярной нейробиологии. 2013 , 49 , 328–333. [ Google Scholar ] [ CrossRef ]
- Шадрина, М.; Коломин, Т.; Агапова, Т.; Агниуллин, Ю.; Шрам, С.; Сломинский, П.; Лимборска, С.; Мясоэдов, Н. Сравнение временной динамики экспрессии генов NGF и BDNF в гиппокампе, лобной коре и сетчатке крысы под действием Семакса. Журнал молекулярной нейронауки. 2010 , 41 , 30–35. [ Google Scholar ] [ CrossRef ]
- Островская Р.У.; Вахитова И.В.; Салимгареева М.К.; Ямиданов Р.С.; Садовников С.В.; Капица И.Г.; Середенин С.Б. О механизме действия ноопепта: снижение активности стресс-индуцированных киназ и повышение экспрессии нейтрофинов. Эксперимент. Клин. Фармакол. 2010 , 73 , 2–5. [ Google Scholar ]
- Умрюхин, П.Е.; Коплик, Е.В.; Гривенников, И.А.; Миасоэдов, Н.Ф.; Судаков, К.В. Экспрессия гена c-Fos в головном мозге крыс, устойчивых и предрасположенных к эмоциональному стрессу, после внутрибрюшинной инъекции аналога АКТГ(4-10)-семакса. Ж. Высш. Нерв. Деят. Им. И.П. Павлов. 2001 , 51 , 220–227. [ Google Scholar ]
- Волкова, А.; Шадрина, М.; Коломин, Т.; Андреева, Л.; Лимборска, С.; Мясоэдов, Н.; Сломинский, П. Введение Селанка влияет на экспрессию некоторых генов, участвующих в ГАМК-эргической нейротрансмиссии. Фронт. Фармакол. 2016 , 7 , 31. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Green Version ]
- Филатова Е.; Касьян А.; Коломин, Т.; Рыбалкина, Е.; Алиева А.; Андреева Л.; Лимборска, С.; Мясоедов Н. ; Павлова Г.; Сломинский, П.; и др. ГАМК, целанк и оланзапин влияют на экспрессию генов, участвующих в ГАМКергической нейротрансмиссии, в клетках IMR-32. Передний. Фармакол. 2017 , 8 , 89. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Козлов, КЛ; Болотов, И.И.; Линкова, Н.С.; Дробинцева, А.О.; Хавинсон, В.К.; Дьяконов, М.М.; Козина, Л.С. Молекулярные аспекты активности вазопротекторного пептида КЕД при атеросклерозе и рестенозе. Adv. Gerontol. 2016 , 29 , 646–650. [ Google Scholar ]
- Хавинсон, В.; Илина, А.; Красковская, Н.; Линкова, Н.; Колчина, Н.; Миронова, Е.; Ерофеев, А.; Петухов, М. Нейропротекторные эффекты трипептидов — эпигенетических регуляторов в мышиной модели болезни Альцгеймера. Фармацевтика 2021 , 14 , 515. [ Google Scholar ] [ CrossRef ]
- Красковская, Н.А.; Куканова, Е.О.; Линькова, Н.С.; Попугаева, Е.А.; Хавинсон, В.К. Трипептиды восстанавливают количество нейрональных шипиков в условиях моделирования болезни Альцгеймера in vitro. Бюллетень экспериментальной биологии и медицины, 2017 , 163 , 550–553. [ Google Scholar ] [ CrossRef ]
- Коломин, Т.; Шадрина, М.; Андреева, Л.; Лимборска, С.; Мясоедов, Н. Экспрессия генов, связанных с воспалением, в селезенке мыши под действием аналога туфтсина Селанка. Регуль. Пепт. 2011 , 170 , 18–23. [ Google Scholar ] [ CrossRef ]
- Коломин, Т.А.; Шадрина, М.И.; Сломинский, П.А.; Лимборска, С.А.; Мясоэдов, Н.Ф. Изменения в экспрессии генов хемокинов, цитокинов и их рецепторов в ответ на селанк и его фрагменты. Генетика 2011 , 47 , 711–714. [ Google Scholar ] [ CrossRef ]
- Медведева, Е.В.; Дмитриева, В.Г.; Поварова, О.В.; Лимборска, С.А.; Скворцова, В.И.; Мясоэдов, Н.Ф.; Дергунова, Л.В. Пептид семакс влияет на экспрессию генов, связанных с иммунной и сосудистой системами, при очаговой ишемии головного мозга крыс: полногеномный транскрипционный анализ. BMC Genom. 2014 , 15 , 228. [ Google Scholar ] [ CrossRef ][ Green Version ]
- Медведева, Е.В.; Дмитриева, В.Г.; Лимборска, С.А.; Мясоэдов, Н.Ф.; Дергунова, Л.В. Семакс, аналог АКТГ (4–7) , регулирует экспрессию генов иммунного ответа при ишемическом повреждении головного мозга у крыс. Молекулярная генетика. Геномика. 2017 , 292 , 635–653. [ Google Scholar ] [ CrossRef ]
- Sun, Y.; Coppé, JP; Lam, EW Клеточное старение: желаемое или нежелательное? Trends Mol. Med. 2018 , 24 , 871–885. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ким, С.Дж.; Миллер, Б.; Кумагаи, Х.; Сильверштейн, А.Р.; Флорес, М.; Йен, К. Митохондриальные пептиды в процессе старения и при возрастных заболеваниях. Geroscience 2021 , 43 , 1113–1121. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Гишар, Г.; Бенкиран, Н.; Зедер-Лутц, Г.; ван Регенмортель, М.Х.; Бриан, Ж.П.; Мюллер, С. Антигенная мимикрия природных L-пептидов с помощью ретро-инверсо-пептидомиметиков. Труды Национальной академии наук США , 1994 , 91 , 9765–9769. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Green Version ]
- Фэн, З.; Сюй, Б. Вдохновение от зеркала: пептиды, содержащие D-аминокислоты, в биомедицинских подходах. Biomol. Concepts 2016 , 7 , 179–187. [ Google Scholar ] [ CrossRef ]
- Бейдун, Т.; Делош, К.; Перино, Дж.; Кирван, Б.А.; Комбетт, Ж.М.; Бехар-Коэн, Ф. Субконъюнктивальная инъекция XG-102, пептида-ингибитора JNK, у пациентов с внутриглазным воспалением: исследование безопасности и переносимости. J. Ocul. Pharmacol. Ther. 2015 , 31 , 93–99. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Green Version ]
- Варсо, МА; Ричардс, Дж.М.; Мехта, Д.; Христов, К.; Шаффер, К.; Рэй Бреслер, Л.; Ямада, Т.; Маджумдар, Д.; Кеннеди, С.А.; Битти, К.В.; и др. Первое в своем классе, первое на людях исследование I фазы p28, пептидного ингибитора убиквитинирования p53, не опосредованного HDM2, у пациентов с распространенными солидными опухолями. Br. J. Cancer 2013 , 108 , 1061–1070. [ Google Scholar ] [ CrossRef ]
- Барр, член парламента; Брандт, РМЦ; Путавет, Д.А.; Кляйн, JDD; Деркс, KWJ; Буржуа, БРМ; Стрик, С.; Райксен, Ю.; ван Виллигенбург, Х.; Фейтель, Д.А.; и др. Направленный апоптоз стареющих клеток восстанавливает гомеостаз тканей в ответ на химиотоксичность и старение. Ячейка 2017 , 169 , 132–147. [ Академия Google ] [ CrossRef
- Хавинсон, ВК; Линкова, НС; Полякова, ВО; Дурнова, АО; Ничик, ТЭ; Кветной, ИМ. Пептиды регулируют экспрессию сигнальных молекул в культурах клеток почек в процессе старения in vitro. Бюллетень экспериментальной биологии и медицины 2014 , 157 , 261–264. [ Google Scholar ] [ CrossRef ]
- Хавинсон, ВК; Линкова, НС; Дятлова, А.С.; Гутоп, Э.О.; Орлова, О.А. Короткие пептиды: Регуляция функции кожи в процессе старения. Adv. Gerontol. 2020 , 33 , 46–54. [ Google Scholar ]
- Линькова, Н.С.; Полякова, В.О.; Трофимов, А.В.; Кветной, И.М.; Хавинсон, В.К. Пептидергическая регуляция дифференцировки, пролиферации и апоптоза тимоцитов в процессе старения тимуса. Бюллетень экспериментальной биологии и медицины. 2011 , 151 , 239–242. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ченг, Коннектикут; Ло, В.; Чен, Дж.; Чен, WC; Лин, CY; Лин, ХК; Ян, CH; Шех, Л. Исследования синтеза и разрыва ДНК нового циклического пептида: Cyclo[Lys-Trp-Lys-Ahx-]. Биоорг. Мед. хим. 2001 , 9 , 1493–1498. [ Академия Google ] [ CrossRef
- Хавинсон, ВК; Соловьев, А.Й.; Шатаева, Л.К. Плавление двухцепочечной ДНК после связывания с геропротекторным тетрапептидом. Бюллетень экспериментальной биологии и медицины, 2008 , 146 , 624–626. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Сидорова Н.И.; Николаев, В.А.; Суровая, АН; Жузе, Ал.; Гурский Г. В. Взаимодействие цистеинсодержащего пептида с ДНК. Мол. Биол. 1991 , 25 , 706–717. [ Академика Google ]
- Колчина, Н.; Хавинсон, В.; Линкова, Н.; Якимов, А.; Байтин, Д.; Афанасьева, А.; Петухов, М. Систематический поиск структурных мотивов связывания пептидов с двухцепочечной ДНК. Nucleic Acids Res. 2019 , 47 , 10553–10563. [ Google Scholar ] [ CrossRef ]
- Хавинсон, ВК; Тарновская, С.И.; Линкова, Н.С.; Червякова, Н.А.; Ничик, Т.Е.; Элашкина, Е.В.; Чалисова, Н.И. Роль пептидной связи в реализации биологической активности коротких пептидов. Вестник эксперим. биол. мед. 2015 , 158 , 551–554. [ Google Scholar ] [ CrossRef ]
- Соловьев А.Ю.; Тарновская С.И.; Чернова И.А.; Шатаева Л.К.; Скорик Ю.А. Взаимодействие аминокислот, пептидов и белков с ДНК. Межд. Ж. Биол. Макромол. 2015 , 78 , 39–45. [ Академия Google ] [ CrossRef ]
- Силантева, И.А.; Комолкин, А.В.; Морозова, Е.А.; Воронцов-Веляминов, П.Н.; Касьяненко, Н.А. Роль моно- и двухвалентных ионов во взаимодействии пептида Glu-Asp-Arg-ДНК. Журнал физиологической химии B 2019 , 123 , 1896–1902. [ Google Scholar ] [ CrossRef ]
- Хавинсон, ВК; Федореева, ЛИ; Ванюшин, БФ. Сайт-специфическое связывание коротких пептидов с ДНК модулирует активность эукариотической эндонуклеазы. Бюллетень экспериментальной биологии и медицины, 2011 , 151 , 66–70. [ Google Scholar ] [ CrossRef ]
- Флок, С.; Байли, Ф.; Байли, К.; Уоринг, М. Дж.; Энишар, Ж. П.; Колсон, П.; Уссье, К. Взаимодействие двух пептидно-акридиновых конъюгатов, содержащих пептидный мотив SPKK, с ДНК и хроматином. Biomol. Struct. Dyn. 1994 , 11 , 881–900. [ Google Scholar ] [ CrossRef ]
- Бурду-Хусио, К.; Колсон, П.; Хуссье, К.; Байли, К. Взаимодействие конъюгатов пептида, пронизывающего ДНК, с амсакрином с ДНК и хроматином. Anticancer Drug Des. 1996 , 11 , 509–525. [ Google Scholar ]
- Сузуки, М.; Герштейн, М.; Джонсон, Т. Исследование мотива SPKK, связывающего ДНК, с помощью ЯМР и модель его взаимодействия с ДНК. Protein Eng. 1993 , 6 , 565–574. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Green Version ]
- Черчилль, М.Е.; Трэверс, А.А. Белковые мотивы, распознающие структурные особенности ДНК. Trends Biochem. Sci. 1991 , 16 , 92–97. [ Google Scholar ] [ CrossRef ]
- Гейерстангер, Б.Х.; Волкман, Б.Ф.; Кремер, В.; Веммер, Д.Е. Короткие пептидные фрагменты, полученные из белков HMG-I/Y, специфически связываются с малой бороздкой ДНК. Биохимия 1994 , 33 , 5347–5355. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Москера, Дж.; Санчес, Мичиган; Валеро, Дж.; де Мендоса, Дж.; Васкес, МЭ; Маскареньяс, Дж. Л. Избирательное последовательность связывания ДНК с проницаемыми для клеток конъюгатами олигогуанидин-пептид. хим. Коммун. Кэмб. 2015 , 51 , 4811–4814. [ Академия Google ] [ CrossRef ] [ Зеленая версия ]
- Этцион-Фукс, А.; Тодд, Д.А.; Сингх, М. dSPRINT: Прогнозирование сайтов взаимодействия ДНК, РНК, ионов, пептидов и малых молекул в пределах белковых доменов. Nucleic Acids Res. 2021 , 49 , e78. [ Google Scholar ] [ CrossRef ]
- Хавинсон В.К.; Лежава, Т.А.; Монаселидзе-младший; Джохадзе, Т.А.; Двалишвили, Н.А.; Баблишвили, НК; Трофимова, С.В. Пептид Эпиталон активирует хроматин в пожилом возрасте. Нейро. Эндокринол. Летт. 2003 , 24 , 329–333. [ Академика Google ]
- Лежава, Т. Хромосомы человека и старение. От 80 до 114 лет. В журнале Nova Biomedical ; издательство Nova Science: Нью-Йорк, штат Нью-Йорк, США, 2006; стр. 1–177. [ Google Scholar ]
- Хавинсон, В.; Шатаева, Л.; Чернова, А. Двойная спираль ДНК связывает регуляторные пептиды аналогично факторам транскрипции. Нейроэндокринные письма. 2005 , 26 , 237–241. [ Google Scholar ]
- Кузник, Б.И.; Давыдов, С.О.; Поправка, Е.С.; Линкова, Н.С.; Козина, Л.С.; Хавинсон, В.К. Эпигенетические механизмы пептид-зависимой регуляции и нейропротекторного белка FKBP1b. Молекулярная биология 2019 , 53 , 339–348.